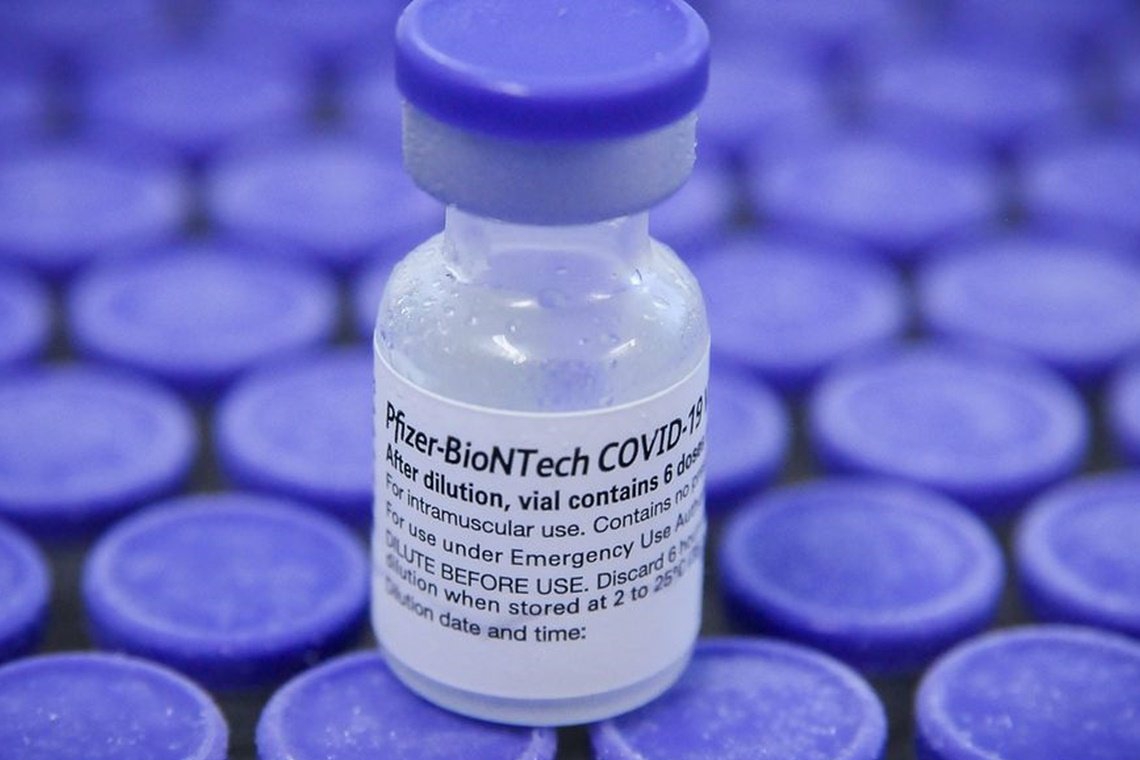
A Agência Nacional de Vigilância Sanitária (Anvisa) recebeu da farmacêutica Pfizer o pedido de autorização de uso emergencial de uma segunda vacina contra Covid-19. Dessa vez, a vacina é constituída de uma mistura da cepa original, usada na vacina ComiRNAty, já aplicada no Brasil desde fevereiro de 2021, e da cepa Ômicron, subvariante BA.1.
Na prática, ela adiciona uma proteção extra a variante Ômicron enquanto também protege da cepa origal. Uma vez recebido o pedido de autorização de uso emergencial, a Anvisa tem 30 dias para concluir a avaliação. Este prazo é interrompido sempre que for necessária a solicitação à empresa de complementação de informações ou esclarecimentos sobre os dados de qualidade, de eficácia e de segurança apresentados.
O Reino Unido foi o primeiro país a aprovar uma vacina voltada para combater a Ômicron. A vacina bivalente, fabricada pelo laboratório norte-americano Moderna, teve aprovação confirmada nesta semana. A decisão do órgão regulador britânico, equivalente à Anvisa, foi baseada em ensaios clínicos que apontaram uma “forte resposta imune” contra a Ômicron desencadeada pelo imunizante.
Diversas
Ômicron: Pfizer pede autorização de uso emergencial de nova vacina contra variante da Covid-19
- by Guilherme Oliveira
- 20 de agosto de 2022
- 0 Comments
- Less than a minute
- 3 anos ago
Share This Post:
Related Post
Entretenimento
Jefinho lança “Recordações”, álbum com 30 regravações emocionantes e
25 de abril de 2025












Leave feedback about this
Você precisa fazer o login para publicar um comentário.